[許全智] 串聯固定金屬離子親和層析法與親水交互作用層析法用於同步且高通量分析植物磷酸化與N-醣基化蛋白質體學
發稿時間: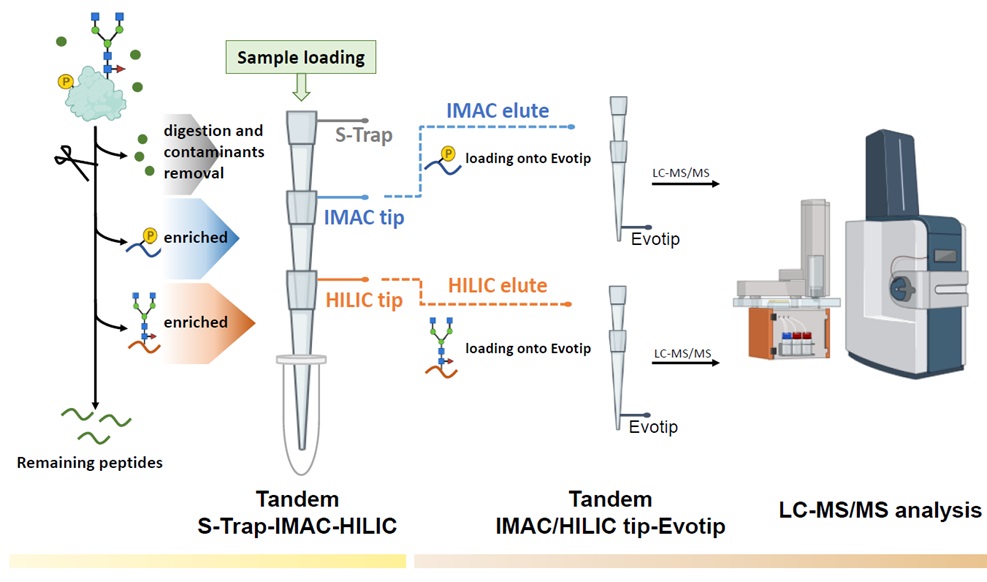
TIMAHAC方法流程的實驗設計,用於同時分析植物磷酸化與N-醣基化蛋白質體學。色素與代謝物的移除和蛋白質酶解在懸浮捕獲微管柱內進行。磷酸化和N-醣基化胜肽通過使用串聯S-Trap-IMAC-HILIC策略並透過離心同時富集。富集的胜肽直接裝載到Evotip上,隨後使用與timsTOF HT質譜儀相連的Evosep液相層析儀系統以數據擷取模式進行分析。
N-醣基化和磷酸化在調節植物對環境刺激的反應中發揮著關鍵作用。然而,目前用於同時分析植物磷酸化與N-醣基化蛋白質體的方法既步驟繁瑣且耗時,限制了分析的通量。針對此一挑戰,蛋白質體核心實驗室開發了一種新穎的串聯懸浮捕獲(S-Trap)、固定金屬離子親和層析(IMAC)與親水相互作用層析(HILIC)策略,稱為TIMAHAC,用於植物磷酸化和N-醣基化蛋白質體的同步分析。此方法將固定金屬離子親和層析和親水交互作用層析整合到串聯微量滴管中,簡化了磷酸化和N-醣基化胜肽的富集過程。關鍵創新在於使用單一的樣品裝載溶液系統和優化的富集順序,以提高N-醣基化胜肽鑑定數目和定量再現性。通過分析阿拉伯芥在一小時離層素處理下的磷酸化和N-醣基化蛋白質體,展示了TIMAHAC的實際應用性。從阿拉伯芥中鑑定出多達1,954個獨特的N-醣基化胜肽和11,255個磷酸化胜肽,顯示其適用於植物組織的大規模同步蛋白後轉譯修飾分析。特別是,在阿拉伯芥磷酸化和N-醣基化蛋白質體中觀察到了不同的離層素誘導擾動模式,表明此兩種後轉譯修飾對離層素刺激有獨特的反應方式。這項結果揭示TIMAHAC提供了一個全面性的分析方法來研究植物中複雜調控機制和蛋白磷酸化和N-醣基化的相互作用,為深入研究植物信號網絡鋪平了道路。
本文第一作者陳瑾玟與第二作者林佩怡為蛋白質體核心實驗室研究助理,此研究成果已發表於美國生物化學與分子生物學會期刊《分子與細胞蛋白質體學》。