[賴爾珉] 甘胺酸拉鍊序列幫助細菌效應蛋白質運送至目標細胞
發稿時間:許多細菌可透過第六型蛋白質分泌系統 (type VI secretion system, T6SS) 分泌效應蛋白質,其功能包含胞外陽離子獲取、提升致病力,並在細菌間競爭中扮演重要角色。過去研究發現非常多不同種類的第六型效應蛋白質,其受質範圍相當廣泛,作用位置包含細胞膜、胞間質與細胞質,然而關於效應蛋白質如何進入目標細胞仍有許多未明的地方,因此了解此機制將有助於了解蛋白質遞送之過程及微生物間的交互作用。
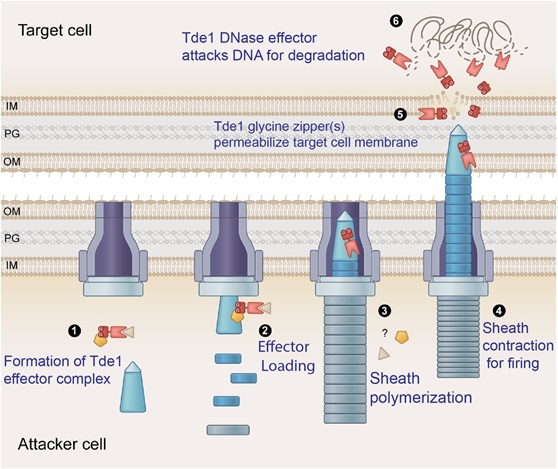
農桿菌為造成冠癭病的土傳性植物病原細菌,會利用第六型分泌系統以獲得細菌間的競爭優勢。本所賴爾珉研究團隊利用C58 菌株的第六型核酸酶效應蛋白質Tde1來解析效應蛋白質如何進入目標細胞的機制。Tde1之N端具有一跨膜域 (transmembrane domain),並和一甘胺酸拉鍊序列 (repetitive GxxxG glycine zipper motifs) 重疊。大量表現 Tde1 將會造成細胞通透性增加,然而若將 Tde1 之 G39xxxG43 的G39和 G43 位點突變即無法觀察到此現象。透過免疫沉澱法、分泌分析、與 DNA 核酸酶活性試驗發現 G39 和 G43 位點突變不影響 Tde1 之分泌和與適配器蛋白質 Tap1 之交互作用,也不影響 Tde1 之核酸酶活性。然而透過綠色螢光蛋白 sfGFP 標定 Tde1 卻發現 G39 和 G43 位點突變株無法被運送進目標細胞之中,透過競爭試驗亦發現 G39 和 G43 位點突變株失去毒殺目標細胞之能力。
本研究指出G39xxxG43甘胺酸拉鍊序列不影響 Tde1 之分泌與酵素活性,而是調控 Tde1 進入目標細胞之中。鑒於甘胺酸拉鍊序列不僅存在於穿孔毒素 (pore-forming toxin),亦廣泛存在於其他細菌之效應蛋白質,因此甘胺酸拉鍊序列可能是許多細菌毒素為了跨越細胞膜以進入細胞質所發展的常見策略。本研究同時也開發觀測效應蛋白質之遞送方法,有助於未來效應蛋白質之研究,此新穎的蛋白質運輸策略亦提供傳統利用DNA在目標細胞中異源表現蛋白質的代替方法。
此論文的第一作者為中央研究院國際研究生院TIGP-MBAS剛通過論文口試的狄杰莫博士,其他作者依序為余文迪、宋立綱、張綺蕙、賴爾珉。此論文已發表於國際期刊EMBO reports。